Conocer los hidratos de carbono

Más información --->
-
-------------------------------------------------------------------------------------------------------
-------------------------------------------------------------------------------------------------------
HIPOGLUCEMIA: ¿QUÉ DEBO SABER?
Para nuestros pacientes, a efectos prácticos debo plantearme: ¿Cuándo pensar en una hipoglucemia?
- Las causas de hipoglucemia suelen ser:
- Por una dosis excesiva de la medicación para la diabetes, que hace que la insulina esté demasiado alta
- Por haber comido menos, más tarde o no haber comido
- Por realizar ejercicio físico intenso
- Por beber alcohol
- Por una mala técnica de inyección (si tienes un tratamiento inyectable)
- Por otra enfermedad: gastroenteritis, diarrea
- El paciente debe conocer los signos de alarma de aparición de una hipoglucemia antes de que se transforme en un fenómeno adverso grave.
- Cuando la hipoglucemia es leve o moderada puedes notar:
- Sudor frío
- Temblores
- Nerviosismo
- Hambre
- Debilidad
- Mareo
- Palpitaciones
- Hormigueos
- Cuando la hipoglucemia es grave, puedes presentar:
- Dolor fuerte de cabeza
- Alteración de la palabra
- Cambios de comportamiento
- Convulsiones
- Pérdida de conciencia
----------------------------------------------------------------------------------------------
----------------------------------------------------------------------------------------------
UN LAGARTO CONTRA LA DIABETES
 |
| Fig. 2. Vista del rio Gila |
En los años 80, el Dr. John Eng, endocrinólogo, trabajaba en el Solomon A. Berson Research Laboratory, Veterans Affairs Medical Center, de Bronx, New York. Su mentor en esta institución era la Dra. Rosalyn S. Yalow, ganadora en 1977 del Premio Nobel de Medicina y Fisiología por el desarrollo de técnicas de radioinmunoanálisis (RIA) de péptidos hormonales. El Dr. Eng perfeccionó las técnicas de ensayo químicas para la detección de nuevas hormonas, que no podían ser detectadas por RIA. En 1990, trabajando con el veneno del lagarto de cuentas (Heloderma horridum), utilizó la técnica de secuenciacion de aminoácidos y la espectrometría de masas para identificar péptidos con estructura amino-terminal histidyl (His1), característica de la mayoría de los péptidos de la superfamilia del glucagón. En este ensayo identificó un péptido en el veneno del lagarto, al que designó como exendin-3 con caracteristicas de secretagogo pancreático. En este péptido se observó una gran homología con el glucagón (48%) y con el glucagon-like peptide 1 (GLP-1) humano (50%). El exedin-3 estimula el aumento de AMP-c intracelular y la liberación de amilasa en acinos pancreáticos aislados de cerdo y se une a los receptores del peptido intestinal vasoactivo (VIP) (1).Pero el Monstruo de Gila tiene otras cualidades que hacen que este animal tenga un gran interés para la ciencia. Una de sus mayores peculiaridades es su bajo ritmo metabólico y su relativamente fresca temperatura corporal reduce más aún su necesidad de ingesta regular de alimentos. El monstruo de Gila posee una fisiología especializada que le ayuda a mantener los niveles energéticos durante sus largos intervalos entre alimentos. Cuando un Monstruo de Gila come, una glándula salival modificada dentro de su boca libera un compuesto llamado exendin-4, que fluye dentro del tracto digestivo y el torrente sanguíneo del lagarto. Aún está por confirmar el papel que juega el exendin-4, aunque parece que prepara al cuerpo del lagarto para recibir, procesar y almacenar nutrientes. Además, se cree que el exendin-4 tiene un rol en la regeneración del intestino del Gila, que se atrofia entre las esporádicas comidas para conservar energía.
 |
| Fig. 3. Exe.din-4 en veneno de Monstruo de Gila. |
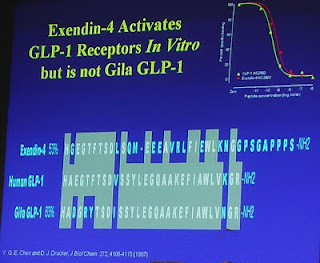
El gráfico de espectrometría (Fig. 3) muestra el pronunciado pico deexedin-4 presente en el veneno del Heloderma suspectum (2). El Dr. Eng quiso averiguar si en el Monstruo de Gila, pariente cercano del lagarto "escorpión", se encontraban los mismos péptidos. Con esta intención, en 1991, trabajando con veneno de Heloderma suspectum, utilizando las mismas técnicas de laboratorio, detectó además del exedin-3, un nuevo péptido, al que denominó exedin-4 (Figura 3) que presentaba diferencias funcionales con el anterior: no produce un segundo pico de concentracion intracelular de AMP-c; no estimula la secreción de amilasa, y no compite con el VIP por los receptores específicos. En este sentido, a diferencia de exedin-3, exedin-4 no tiene efectos vasoactivos (2). Todo ello indicaba que el nuevo péptido (exedin-4) solo interactuaba con receptores específicos (receptores de exedin), descritos poco antes por el mismo grupo de investigadores (3).
GLP-1: UN MENSAJERO Y ALGO MÁS
 |
| Fig. 4. Efectos fisiológicos de GLP-1 |
 |
| Figura 6 |
 A pesar
de exhibir los mismos perfiles de glucemia, hay diferencias
significativas en la respuesta de las células beta
a la glucosa oral versus la glucosa en infusión intravenosa, en
relacion con los niveles del péptido C (Figura 5) (7).
A pesar
de exhibir los mismos perfiles de glucemia, hay diferencias
significativas en la respuesta de las células beta
a la glucosa oral versus la glucosa en infusión intravenosa, en
relacion con los niveles del péptido C (Figura 5) (7).La respuesta secretora de las células beta a la ingestión de glucosa, medida por los aumentos en la insulina plasmática, está reducida en pacientes con diabetes.
Los pacientes con diabetes exhibieron una mayor respuesta secretora de las células beta que los sujetos control, según lo indicado por los niveles más elevados de secreción de insulina, durante el curso de 180 minutos de la infusión intravenosa de glucosa (Figura 6) (7).
 Mas del 70 % de la de la secreción de insulina post-ingesta de
glucosa se debe al efecto incretina, el efecto insulinotrópico
de GIP y GLP-1. El GLP-1 es responsable de la mayor parte del efecto
incretina. Los niveles postprandiales de GLP-1 están reducidos
en pacientes con DM2 (8).
Mas del 70 % de la de la secreción de insulina post-ingesta de
glucosa se debe al efecto incretina, el efecto insulinotrópico
de GIP y GLP-1. El GLP-1 es responsable de la mayor parte del efecto
incretina. Los niveles postprandiales de GLP-1 están reducidos
en pacientes con DM2 (8).Es sabido que la tolerancia a la glucosa puede ser restaurada por la inyeccion intravenosa de GLP-1 en pacientes con DM2.
MIMÉTICOS DE INCRETINAS: UNA NUEVA CLASE DE FÁRMACOS
 |
| Figura 7. Resumen de las estrategias terapéuticas basadas en las incretinas |
La sustancia exendin-4 muestra un efecto similar a GLP-1, pero a diferencia de este, que regula los niveles de glucosa y provoca saciedad, pero que tiene una vida media muy corta, la accion reguladora, glucosa-dependiente la exedin-4 se mantine durante algo más de 12 horas. La utilizacion de GLP-1 como droga potencial en el tratamiento de la DM2, necesitaría de inyecciones repetidas de la sustancia para mantener su efecto de control de la glucemia, pero no así la exedin-4. El Dr. Eng cedió la licencia de su descubrimiento (exedin-4) a Amylin Pharmaceuticals, Inc., que denominó al producto sintético AC2993 (exenatide). Durante los periodos de ayuno el exenatide muestra un efecto estimulante de la secreción de insulina glucosa-dependiente, así como una acción supresora de la secreción de glucagón. En el periodo postprandial se añade un efecto de retardo del vaciamiento gástrico. El efecto glucosa-dependiente hace que el tratamiento con exenatide no se asocie a un incremento de las hipoglucemias. Estos sólidos efectos antidiabéticos convierten a AC2993 en un tratamiento eficaz (Figura 8) (9).
 |
| Figura 8. Niveles medios de concentración postprandial de glucosa tras una sola dosis de placebo (•) o 0.1 µg/kg de AC2993 ( |
En la actualidad, Amylin Pharmaceuticals investiga sobre exenatide en administración semanal. Se trata de una exenatide de liberación prolongada. También se investiga en la administracion nasal y transdérmica de exenatide (12).
ANÁLOGOS DE INCRETINAS
Liraglutida estimula la liberación de insulina en respuesta al incremento de los niveles de glucosa en sangre (16). Además produce una mejoría de la función de las células pancreáticas (beta y alfa) y disminuye la liberación endógena de glucosa desde el hígado (17). Por otra parte, es una terapia bien tolerada, siendo los efectos secundarios más frecuentes las nauseas (entre el 5% y 29% de los pacientes), generalmente ligeras y al comienzo del tratamiento, aunque suele ser un efecto transitorio, que no obliga a la interrupción del mismo. La tasa de hipoglucemia es baja, calculandose en 0.03 a 1.9 eventos por paciente/año. Se ha observado, además, descenso de la presión arterial sistólica (un descenso medio superior a 6.7 mm Hg) y del peso corporal (una media superior a 3.24 kg.) (18).
INHIBIDORES DE LA ENZIMA DPP-4
En la actualidad existen varios fármacos inhibidores de la enzima DPP-4 (sitagliptina, vildagliptina y saxagliptina) que se han mostrado utiles en el tratamiento de la DM2, como así lo aconfirman las revisiones sistemáticas realizadas sobre los ensayos publicados (22, 23). Existen cuestiones importantes aún por resolver relacionadas con los efectos a largo plazo del tratamiento de la DM2 con inhibidores de la DPP-4, especialmente en relación con con su influencia sobre la inmunidad (24) y el sistema cardiovascular. DPP-4 puede jugar un papel en la regulación de la migración de CD34+. Una fracción de las células circulantes progenitoras de CD34+, las células progenitoras endoteliales (EPCs), parecen jugar un papel significativo en el mantenimiento de la salud endotelial promoviendo la re-endotelización y neovascularización en el contexto de lesion vascular e isquemia tisular, respectivamente. En los pacientes con DM se encuentra disminuido el número y la función de EPCs. Ello puede explicar, al menos en parte, porqué los pacientes con DM son mas susceptibles a la enfermedad cardiovascular. Estos mismos pacientes muestran un incremento de la actividad DPP-4. Queda por determinar la influencia de los inhibidores de la DPP-4 en pacientes con DM2 y elevado riesgo cardiovascular (25).
LOS OTROS HABITANTES DE LA CUENCA DEL RIO GILA
 Antes
de la llegada de los españoles a la región del sudoeste de los
actuales EE.UU. de América (alrededor del año 1539), en las riveras
de los rios Gila, Salado de Arizona, Yaqui y Sonora, vivían los
indios Pima (akimel o'odham en el dialecto indio). Y, antes
que ellos, habitaron esas cuencas, de los rios afluentes del
Colorado, otras tribus, a los que los Pima denominan Hohokam
("los que se fueron" en el idioma pima). De estos
predecesores de los Pimas quedaron restos de edificaciones y, sobre
todo, sistemas de irrigación construidos alrededor del rio Gila. En
la actualidad, la mayoría de la población pima vive en la Comunidad
India de Salt River Pima-Maricopa y en la Comunidad de Gila River,
que comparten con el pueblo maricopa. Otros asentamientos menos
densos de esta etnia están distribuidos entre la Comunidad Ak-Chin
del Valle de Santa Cruz de Arizona y también se encuentran reducidos
asentamientos en el norte de Sonora. Según las cifras demográficas
totales (100.786 en el último censo), el pueblo pima puede
considerarse un grupo étnico en peligro de desaparición (26).
Antes
de la llegada de los españoles a la región del sudoeste de los
actuales EE.UU. de América (alrededor del año 1539), en las riveras
de los rios Gila, Salado de Arizona, Yaqui y Sonora, vivían los
indios Pima (akimel o'odham en el dialecto indio). Y, antes
que ellos, habitaron esas cuencas, de los rios afluentes del
Colorado, otras tribus, a los que los Pima denominan Hohokam
("los que se fueron" en el idioma pima). De estos
predecesores de los Pimas quedaron restos de edificaciones y, sobre
todo, sistemas de irrigación construidos alrededor del rio Gila. En
la actualidad, la mayoría de la población pima vive en la Comunidad
India de Salt River Pima-Maricopa y en la Comunidad de Gila River,
que comparten con el pueblo maricopa. Otros asentamientos menos
densos de esta etnia están distribuidos entre la Comunidad Ak-Chin
del Valle de Santa Cruz de Arizona y también se encuentran reducidos
asentamientos en el norte de Sonora. Según las cifras demográficas
totales (100.786 en el último censo), el pueblo pima puede
considerarse un grupo étnico en peligro de desaparición (26).Desde la década de los años 50 del siglo pasado, la población autóctona del sudoeste de los Estados Unidos de America, ha sido objeto de numerosos estudios relacionados con la diabetes. Concretamente la etnia Pima ha concentrado el interés de los investigadores en DM (27).
Continuará ....
BIBLIOGRAFIA
1. Eng, J., Andrews, P. C., Kleinman, W. A., Singh, L., and Raufman, J.-P. Purification and Structure of Exendin-3, a New Pancreatic Secretagogue Isolated from Heloderma horridurn Venom*. J. Biol. Chem. 1990; 265:20259-20262.
2. Eng J, Kleinman WA, Singh L, Singh G, Raufman JP. Isolation and characterization of exendin-4, an exendin-3 analogue, from Heloderma suspectum venom. Further evidence for an exendin receptor on dispersed acini from guinea pig pancreas. J. Biol. Chem. 1992; 267:7402-7406.
3. Raufman, J.-P., Singh, L., and Eng, J. Exendin-3, a novel peptide from Heloderma horridum venom, interacts with vasoactive intestinal peptide receptors and a newly described receptor on dispersed acini from guinea pig pancreas. Description of exendin-3(9-39) amide, a specific exendin receptor antagonist. J. Biol. Chem. 1991; 266:2897-2902.
4. Solcia E, Fiocca R, Capella C, Usellini L, Sessa F, Rindi G, Schwartz TW, Yanaihara N. Glucagon- and PP-related peptides of intestinal L cells and pancreatic/gastric A or PP cells. Possible interrelationships of peptides and cells during evolution, fetal development and tumor growth. Peptides. 1985; 6 Suppl 3:223-9.
5. Ward WK, Beard JC, Halter JB, Pfeifer MA, Porte D Jr.. Pathophysiology of insulin secretion in non-insulin-dependent diabetes mellitus. Diabetes Care. 1984; 5:491-502.
6. DeFronzo RA, Bonadonna RC, Ferrannini E.. Pathogenesis of NIDDM. A balanced overview. Diabetes Care. 1992; 3:318-68.
7. Nauck MA, Homberger E, Siegel EG, Allen RC, Eaton RP, Ebert R, Creutzfeldt W. Incretin effects of increasing glucose loads in man calculated from venous insulin and C-peptide responses. J Clin Endocrinol Metab. 1986; 63:492-8.
8. Toft-Nielsen MB, Damholt MB, Madsbad S, Hilsted LM, Hughes TE, Michelsen BK, Holst JJ. Determinants of the impaired secretion of glucagon-like peptide-1 in type 2 diabetic patients. J Clin Endocrinol Metab. 2001; 86:3717-23.
9. Kolterman, O, Buse J, Fineman M, Gaines E, Heintz S, Bicsak T, Taylor K, Kim D, Aisporna M, Wang Y, Baron A. Synthetic exendin-4 (exenatide) significantly reduces postprandial and fasting glucose in subjects with type 2 diabetes. Journal of Clinical Endocrinology & Metabolism. 2003; 88:3082-3089.
10. DeFronzo RA, Ratner RE, Han J, et al. Effects of exenatide (exendin-4) on glycemic control and weight over 30 weeks in metformin-treated patients with type 2 diabetes. Diabetes Care. 2005; 28:1092-1100.
11. Klonoff DC, Buse JB, Nielsen LL, et al. Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years. Curr Med Res Opin. 2008; 24:275-286.
12. http://www.amylin.com/research/pipeline/exenatide.htm
13. Knudsen LB, Nielsen PF, Huusfeldt PO, Johansen NL, Madsen K, Pedersen FZ, Thøgersen H, Wilken M, Agersø H. Potent derivatives of glucagon-like peptide-1 with pharmacokinetic properties suitable for once daily administration. J Med Chem. 2000; 43:1664-9.
14. Larsen PJ, Fledelius C, Knudsen LB, Tang-Christensen M. Systemic administration of the long-acting GLP-1 derivative NN2211 induces lasting and reversible weight loss in both normal and obese rats. Diabetes. 2001; 50:2530-9.
15. Juhl CB, Hollingdal M, Sturis J, Jakobsen G, Agersø H, Veldhuis J, Pørksen N, Schmitz O. Bedtime administration of NN2211, a long-acting GLP-1 derivative, substantially reduces fasting and postprandial glycemia in type 2 diabetes. Diabetes. 2002; 51:424-9.
16. Mark M. NN-2211 Novo Nordisk. IDrugs. 2003; 6:251-8.
17. Degn KB, Juhl CB, Sturis J, Jakobsen G, Brock B, Chandramouli V, Rungby J, Landau BR, Schmitz O. One week's treatment with the long-acting glucagon-like peptide 1 derivative liraglutide (NN2211) markedly improves 24-h glycemia and alpha- and beta-cell function and reduces endogenous glucose release in patients with type 2 diabetes. Diabetes. 2004; 53:1187-94.
18. Montanya E, Sesti G. A review of efficacy and safety data regarding the use of liraglutide, a once-daily human glucagon-like peptide 1 analogue, in the treatment of type 2 diabetes mellitus. Clin Ther. 2009; 31:2472-88.
19. Davies MJ, Kela R, Khunti K. Liraglutide - overview of the preclinical and clinical data and its role in the treatment of type 2 diabetes. Diabetes Obes Metab. 2011; 13:207-20.
20. Mannucci E, Pala L, Ciani S, Bardini G, Pezzatini A, Sposato I, Cremasco F, Ognibene A, Rotella CM. Hyperglycaemia increases dipeptidyl peptidase IV activity in diabetes mellitus. Diabetologia. 2005; 48:1168-72.
21. Deacon CF, Hughes TE, Holst JJ: Dipeptidyl peptidase IV inhibition potentiates the insulinotropic effect of glucagon-like peptide-1 in the anesthetized pig. Diabetes. 1998; 47:764–769.
22. Holst JJ, Deacon CF. Inhibition of the activity of dipeptidyl-peptidase IV as a treatment for type 2 diabetes. Diabetes. 1998; 47:1663-70.
22. Wani JH, John-Kalarickal J, Fonseca VA. Dipeptidyl peptidase-4 as a new target of action for type 2 diabetes mellitus: a systematic review. Cardiol Clin. 2008; 26:639-48.
23. Campbell RK. Rationale for dipeptidyl peptidase 4 inhibitors: a new class of oral agents for the treatment of type 2 diabetes mellitus. Ann Pharmacother. 2007; 41:51-60.
24. Richter B, Bandeira-Echtler E, Bergerhoff K, Lerch CL. Inhibidores de la dipeptidil peptidasa-4 (DPP-4) para la diabetes mellitus tipo 2 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4.
25. Szmitko PE, Leiter LA, Verma S. The incretin system and cardiometabolic disease. Can J Cardiol. 2010; 26:87-95.
26. http://es.wikipedia.org/wiki/Pima
27. Cohen, B. M.: Diabetes mellitus among Indians of the American Southwest. Ann. Intern. Med. 40:588, 1954.
28. Parks JH, Waskow E. Diabetes among the Pima Indians of Arizona. Ariz Med. 1961;18:99-106.
29. Genuth SM, Bennett PH, Miller M, Burch TA. Hyperinsulinism in obese diabetic Pima Indians. Metabolism. 1967;16:1010-5.




No hay comentarios:
Publicar un comentario