La asociación entre el tratamiento con estatinas y la disminución de riesgo de tromboembolismo venoso es un efecto no completamente aclarado. En las dos últimas décadas se ha observado, en diferentes ensayos clínicos, estudios observacionales y metaanálisis, la disminución de dicho riesgo en diferentes contextos clínicos y con diferentes fármacos. Este artículo pretende revisar los conocimientos acumulados al respecto, en los diferentes trabajos, hasta los más actuales y exponer algunos conceptos fisiopatológicos, que pretenden relacionar tratamiento con estatinas y tromboembolismo venoso (TEV).
Estatinas y riesgo endotelial
Desde hace décadas existen datos que indican el beneficio endotelial del tratamiento con estatinas. El paradigma actual se mueve hacia considerar que la mejora intensiva del estilo de vida y la terapia agresiva con estatinas son dos pilares en la prevención de la enfermedad cardiovascular (ECV). Por demás, parece claro que, en pacientes con alto riesgo, el tratamiento agresivo para reducir los factores de riesgo debe instaurarse precozmente y mantenerse durante años. Dado que el período de incubación y los signos y síntomas de la aterosclerosis abarcan décadas, los ensayos aleatorizados de pocos años de duración brindan escasa información sobre los resultados del tratamiento con estatinas entre los 40 y los 60 años de edad. En este sentido, la reconsideración de los objetivos y la aceptación de la magnitud del problema de la ECV, reafirman la importancia del uso de estatinas, además de ser estrictos en el cumplimiento de las medidas de cambio a hábitos saludables, en la prevención de eventos (1).
La inflamación está involucrada en todas las fases de la aterosclerosis y el proceso avanza implacablemente durante décadas a lo largo de la vida. La proteína C reactiva ultrasensible (PCR-hs) (Figura 1) (*) es un marcador de inflamación inespecífico bien estudiado, que puede reflejar un riesgo general para la salud. Además la PCR-hs es un predictor independiente de eventos cardiovasculares futuros, pero la participación directa en la aterosclerosis sigue siendo controvertida. La PCR-hs proporciona información sobre la activación de las citoquinas que provocan la inflamación. Los niveles altos de PCR-hs se asocian con disfunción endotelial. En las guías se recomienda acepta el uso de PCR-hs para la valoración de riesgo vascular en pacientes específicos con riesgo intermedio.
(*) La proteína PCR-hs es un reactivo de fase aguda descubierto por Tillett y Francis en la Universidad Rockefeller en 1930 en sangre de pacientes con neumonía. Se cristalizó en 1947 y más de 70 años después, todavía existe controversia sobre su fisiología y aplicaciones en biomedicina. La proteína PCR-hs es una pentraxina compuesta por 5 subunidades (Figura 1) que se sintetiza principalmente en el hígado y desempeña un papel activo en la regulación del sistema inmunológico innato. Dado que los niveles de ARNm de PCR-hs aumentan en el tejido adiposo a medida que la expresión de PCR-hs aumenta in vitro por la interleucina-6 (IL-6), las células adiposas también tienen cierta capacidad para sintetizar PCR-hs. La inmunidad innata y la inmunidad adaptativa modulan significativamente la aterosclerosis, con potencial pro y antiaterogénico (1).
Las concentraciones de PCR-hs entre 2 y 10 mg/L se consideran signo de inflamación metabólica y resultado de las alteraciones que causan arteriosclerosis, así como en el curso de la diabetes.
El estudio JUPITER (Justification for Use of statins in Prevention: an Intervention Trial Evaluating Rosuvastatin) (1) se diseñó después de observar que, cuando se redujeron tanto las niveles de LDL como los de la PCR-hs, los pacientes tuvieron mejor pronóstico cardiovascular, que cuando solo se redujo el LDL. Ha sido ampliamente reconocido que los beneficios de la rosuvastatina en JUPITER fueron reales. Por ello, la FDA de EE. UU., extendió las indicaciones de rosuvastatina para incluir a las personas asintomáticas con un factor de riesgo adicional.
El output primario de aquel ensayo fue la aparición de un primer evento cardiovascular importante, definido como infarto de miocardio no fatal, accidente cerebrovascular no fatal, hospitalización por angina inestable, un procedimiento de revascularización arterial o muerte confirmada por causas cardiovasculares. Como outputs secundarios se eligieron los componentes del end-point primario considerados individualmente (revascularización arterial u hospitalización por angina inestable, infarto de miocardio, accidente cerebrovascular o muerte por causas cardiovasculares), además de muerte por cualquier causa.
La rosuvastatina redujo los niveles de colesterol LDL en un 50% y los niveles de PCR ultrasensible en un 37%.
En el momento de la finalización del estudio (mediana de seguimiento, 1,9 años; seguimiento máximo, 5,0 años), se habían producido 142 primeros eventos cardiovasculares importantes (end-point primario) en el grupo de rosuvastatina, en comparación con 251 en el grupo de placebo (Tabla 1). Las tasas del criterio de valoración principal fueron 0,77 y 1,36 por 100 personas-año de seguimiento en los grupos de rosuvastatina y placebo, respectivamente (índice de riesgo para rosuvastatina, 0,56; intervalo de confianza [IC] del 95%, 0,46 a 0,69; P < 0.00001).
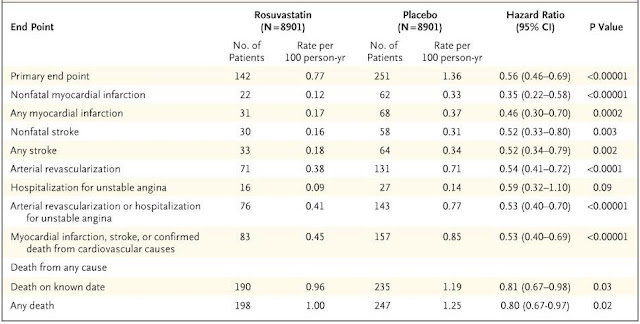 |
Tabla
1: Resultados según el grupo
de estudio. Ridker
PM, Danielson
E, Fonseca
FAH,
et al., (JUPITER Study Group). (2) |
El fármaco se asoció con reducciones significativas en las tasas de los componentes individuales del criterio de valoración principal del ensayo (Figura 2). Para el punto final de infarto de miocardio fatal o no fatal, las tasas de eventos fueron 0,17 y 0,37 por 100 personas-año de seguimiento en los grupos de rosuvastatina y placebo, respectivamente (cociente de riesgo para rosuvastatina, 0,46; IC del 95%, 0,30 a 0,70; P = 0,0002). Las tasas correspondientes fueron 0,18 y 0,34 para accidente cerebrovascular mortal o no mortal (índice de riesgo, 0,52; IC del 95%, 0,34 a 0,79; P = 0,002), 0,41 y 0,77 para la revascularización arterial o angina inestable (índice de riesgo, 0,53; IC del 95%, 0,40 a 0,70; P <0,00001) y 0,45 y 0,85 para el criterio de valoración combinado de infarto de miocardio no mortal, accidente cerebrovascular no mortal o muerte por causas cardiovasculares (índice de riesgo, 0,53; IC del 95%, 0,40 a 0,69; P <0,00001).
Por otra parte, la American Heart Association y los Centers of Disease Control and Prevention, aceptaron previamente el uso de PCR-hs como parámetro valioso de riesgo vascular (inflamación endotelial) en personas con "riesgo intermedio" según lo definido por las puntuaciones de riesgo global.
La Canadian Cardiovascular Society fue un poco más allá, recomendando el uso de estatinas en personas con niveles bajos de LDL y niveles altos de PCR-hs en riesgo intermedio. El estudio JUPITER centró la atención en individuos aparentemente sanos con perfiles de lípidos "normales" y valores altos de PCR-hs que se beneficiaron de la terapia con estatinas.
Todo ello nos habla sobre el efecto antiinflamatorio, a nivel endotelial, que parecen exhibir las estatinas en general y la rosuvastatina en particular (1,2). Además JUPITER demostró que, en prevención primaria, la rosuvastatina redujo los eventos de ECV en mujeres con una reducción relativa del riesgo similar a la de los hombres, un hallazgo respaldado por un metaanálisis de ensayos de estatinas en prevención primaria (3).
El estudio AURORA, un ensayo desarrollado para evaluar el uso de rosuvastatina en sujetos en hemodiálisis regular, con evaluación de la supervivencia y los eventos cardiovasculares, fue realizado en un grupo muy especial de pacientes con elevado riesgo cardiovascular, como son los pacientes con enfermedad renal crónica (ERC) en estadio terminal, sometidos a hemodiálisis. Las tasas de morbilidad cardiovascular y mortalidad son sustancialmente mas elevadas entre pacientes con ERC que sin ella. Por ello resulta crucial encontrar un método eficaz de prevención de ECV en este particular grupo de la población de pacientes (4).
El criterio de valoración principal investigado en AURORA fue el tiempo transcurrido hasta un evento cardiovascular importante, definido como infarto de miocardio no fatal, accidente cerebrovascular no fatal o muerte por una causa cardiovascular. Los criterios de valoración secundarios incluyeron: mortalidad por todas las causas, muerte por causas no cardiovasculares, supervivencia libre de eventos cardiovasculares (es decir, libre de infarto de miocardio no fatal, accidente cerebrovascular no fatal, muerte por cualquier causa), revascularización coronaria o periférica y procedimientos realizados para estenosis o trombosis de injertos arteriovenosos o fístulas que se estaban utilizando para hemodiálisis.
Sin embargo el estudio AURORA no demostró beneficio del uso de estatinas, concretamente rosuvastatina, en este grupo de pacientes con ERC, como ya había mostrado un estudio anterior que había valorado el uso de atorvastatina en este tipo de pacientes (5).
Se sugiere que la ECV, en pacientes sometidos a hemodiálisis, tiene características diferenciales con el resto de la población sin enfermedad renal o incluso de aquellos en estadios menos avanzados de ERC.(por ejemplo en estadios 1 a 3).
Además se hace notar que muchos de los pacientes con ERC en estadio terminal tienen una elevada presencia de calcificaciones en el árbol vascular, incluyendo calcificación de la capa media vascular y calcificaciones valvulares, que no son tratables con estatinas. Por ello, si bien la calcificación medial e íntima (aterosclerótica) puede tener algunos factores de riesgo compartidos, la distinción de los dos tipos de calcificación es importante porque la detección, el tratamiento y el pronóstico pueden diferir (6).
Estatinas y riesgo de tromboembolismo venoso (TEV)
Desde hace mas de dos décadas se baraja la posibilidad de que las estatinas puedan ser eficaces en la prevención de TEV. En el año 2000 se publicó el primer trabajo que ponía de manifiesto que, el uso de estatinas, se asociaba con un descenso del 50% del riesgo de TEV en mujeres postmenopáusicas en tratamiento con estrógenos y progestágenos (7).
Desde entonces se han publicado otros muchos estudios que han puesto de manifiesto la asociación entre el uso de estatinas y un menor riesgo de TEV. Por otra parte, el uso de estatinas se ha asociado no solo a un menor riesgo de TEV, sino también con otros numerosos y dispares efectos beneficiosos (menores riesgos de arritmia, de esclerosis múltiple, de demencia de Alzheimer, de infecciones, SIDA, mortalidad por cáncer e incluso de accidentes por vehículos de motor), que hacen que se plantee la posibilidad de diferentes tipos de sesgo, ya que estos resultados no parecen depender de menores los niveles de lípidos, como consecuencia del tratamiento con estatinas.
En el caso de la TEV se han considerado tres posibles tipos de sesgo:
- Sesgo del “usuario sano”: las estatinas se prescriben preferentemente en sujetos con un perfil de riesgo favorable, independientemente de que individuos sanos puedan ser incluidos en estudios observacionales. Este sesgo es poco probable para la asociación positiva entre TEV y estatinas, ya que la indicación clásica de estas es la ECV, que comparte factores de riesgo con la TEV.
- Sesgo de supervivencia: evidencia indirecta de que el riesgo de trombosis venosa aumenta en los primeros meses de tratamiento con estatinas, ya que, para la terapia con estatinas, es indicación común un evento cardiovascular arterial reciente. Teniendo en cuenta que los pacientes con ECV arterial aguda tienen un mayor riesgo de TEV posterior y muerte durante un período corto de tiempo.
- Sesgo de adherencia: los usuarios predominantes en un estudio, usan una estatina en el momento de la inclusión, mientras que aquellos que tenían una indicación para el tratamiento con estatinas, pero no continuaron con su tratamiento, son considerados como no usuarios de estatinas. La adherencia a un fármaco es un marcador de una constelación de factores no medidos y probablemente se asocia con un mejor resultado, independientemente del uso del fármaco en sí.
Las características farmacológicas varían entre los tipos de estatinas, mostrando diferentes efectos reductores sobre las lipoproteínas de baja densidad (LDL), la aterosclerosis y la inflamación. De menos a más, la reducción es menor con pravastatina, algo mayor para simvastatina y atorvastatina y más fuerte en los usuarios de rosuvastatina (8, 9).
Las principales condiciones que debería cumplir el fármaco óptimo en esa tarea de prevención de TEV serían: eficacia probada en la prevención de TEV, facilidad de administración y escaso riesgo de hemorragia.
La dislipidemia puede ser uno de los muchos factores sistémicos asociados, no solo con la trombosis arterial, sino también con la TEV. Esto podría deberse a los efectos sobre el endotelio vascular (venoso) de las moléculas lipídicas circulantes, así como a una interacción con la función plaquetaria y los factores de coagulación. Al interferir en estos mecanismos, las estatinas pueden proteger contra la trombosis venosa (10, 11).
Algunos de los primero ensayos, realizados con un numero limitado de pacientes no apoyaron claramente la hipótesis de que el tratamiento con estatinas pudiera proteger de un TEV, en sujetos por otra parte sanos. Quedaba, sin embargo, la posibilidad de probar el tratamiento preventivo con estatinas en pacientes con enfermedad cardiovascular preexistente (12).
Los estudios han establecido una relación entre la inflamación y el tromboembolismo venoso (TEV). Las estatinas modulan la inflamación. Algunos ensayos mostraron ya hace mas de una década que las estatinas previenen la TEV en adultos mayores sanos, quedando, no obstante, al margen de las pruebas de su utilidad otros grupos poblacionales, como individuos más jóvenes y los que tienen comorbilidades.
Un metaanálisis de 2011, llevado a cabo por investigadores del Department of Medicine, McMaster University (Hamilton, Ontario, Canada) y de la Division of General Internal Medicine, Northwestern University's Feinberg School of Medicine (Chicago, Illinois), se planteó como objetivo estimar el efecto de las estatinas sobre la TEV en un grupo heterogéneo de adultos.
Para ello revisó sistemáticamente el efecto de las estatinas en la prevención de TEV en pacientes adultos hospitalizados y ambulatorios, mediante búsquedas sistemáticas en MEDLINE (1966-enero de 2010), EMBASE (1980-enero de 2010), Google Scholar, Cochrane Library, PapersFirst, ProceedingsFirst e ISI Web of Science. Se revisaron manualmente las referencias, además de contactar con expertos. Se incluyeron estudios observacionales, que compararon cualquier dosis de estatina con ninguna estatina o placebo y examinaron pacientes hospitalizados o ambulatorios y en los que fue evaluada la TEV, la embolia pulmonar y/o la trombosis venosa profunda.
Cuatro estudios de cohortes y cuatro estudios de casos y controles cumplieron los criterios. Al comparar las estatinas con el control, la razón de posibilidades de TEV fue de 0,67 (intervalo de confianza del 95%: 0,53; 0,84) y para la trombosis venosa profunda fue de 0,53 (intervalo de confianza del 95%: 0,22; 1,29). La asociación se atenuó en los estudios de menor calidad y en los estudios que incluían a personas mayores.
Los autores concluyeron que, a pesar de la asociación positiva de las estatinas con el desarrollo y evolución de la TEV y la trombosis venosa profunda, eran precisos ensayos bien diseñados dirigidos a estimar la eficacia de prevención de TEV en población heterogéneas de adultos. Así como analizar la rentabilidad del uso de estatinas en esta indicación (13).
Algunos estudios sugieren que la dislipidemia, inflamación endotelial o aterosclerosis, determinantes de la ECV arterial, también aumentan el riesgo de trombosis venosa (14).
Por lo tanto, en caso de una asociación causal mediada por dislipidemia, inflamación o aterosclerosis, el efecto sobre el riesgo de trombosis venosa debería ser más fuerte en rosuvastatina y más débil con pravastatina. En un estudio de cohorte de casi 2 millones de personas del Reino Unido, cuyo objetivo fue valorar y cuantificar los efectos indeseables asociados al uso de las estatinas, según el tipo, dosis y duración del uso de las mismas, el uso de rosuvastatina se asoció con la reducción más fuerte (aproximadamente 40%) del riesgo de padecer TEV (Tabla 2) (15)
Los resultados observados en relación con las estatinas, y particularmente con rosuvastatina, son similares a los obtenidos en ensayos randomizados controlados (16, 17).
Estatinas, coagulación y aterosclerosis
Los resultados de estudios disponibles señalan un menor riesgo de TEV asociado al uso de las estatinas con perfiles anti-ateroscleróticos más potentes. Sin embargo, no se conoce claramente la relación fisiopatológica entre la aterosclerosis y la trombosis venosa. Aunque ciertas evidencias biológicas indicarían causalidad en esta asociación, como que el sistema hemostático puede modular la aterosclerosis (18).
En estudios en animales de experimentación, con fenotipo de coagulación aumentada vs disminuida, se ha observado que la coagulación disminuida confería protección frente al desarrollo de aterosclerosis. Por el contrario, en los animales con hipercoagulación se desarrolló una aterosclerosis mas severa (19).
No se sabe cual es la causa por la que los estudios en humanos han demostrado la presencia de un estado procoagulante mas frecuentemente asociado a lesiones ateroscleróticas en estadio precoz, que en presencia de lesiones avanzadas, aunque se supone que podría deberse a la existencia de mecanismos protectores primarios contra la lesión vascular (20).
Estatinas, inflamación y estado procoagulante
El marcador inflamatorio PCR-hs se asocia no solo con la aterosclerosis, sino también con un mayor riesgo de trombosis venosa (21) y con niveles más altos de factor VIII procoagulante.
Las estatinas, inicialmente sintetizadas para tratar la dislipidemia y ralentizar la aterosclerosis, también demostraron que tienen propiedades antiinflamatorias (22). La aterosclerosis produce una respuesta tanto inflamatoria como procoagulante (18); por tanto, la reducción de la inflamación endotelial por estatinas podría estar detrás de la reducción del riesgo de TEV, observado con estos fármacos.
En un pequeño estudio observacional, la administración de atorvastatina durante 3 días consecutivos en 26 pacientes con TEV redujo la inflamación, constatado por la reducción de los niveles de citoquinas, como interleucina IL-6, IL-8 y P-selectina soluble, junto con un aumento de la citoquina antiinflamatoria IL-10, sin ningún efecto significativo sobre la PCR-hs. Debido al corto intervalo de tiempo, este estudio sugiere beneficios potenciales de la administración de estatinas con respecto a la reducción del riesgo de trombosis venosa que es en parte impulsado por un efecto antiinflamatorio inmediato (es decir, no relacionado con la aterosclerosis) (23)
Estatinas y activación plaquetaria
Estudios in vitro han demostrado que las estatinas inhiben la activación plaquetaria y, por tanto, la agregación por diversos mecanismos, independientemente de su acción hipolipemiante. Estos mecanismos incluyen la inhibición de la formación de tromboxano A2 (TxA2) (24).
Aunque se ha puesto en duda este mecanismo, no se excluyen otros posibles efectos antiplaquetarios, concretamente de la rosuvastatina, ya que se pueden medir utilizando diferentes pruebas de función plaquetaria (25). Hace mas de dos décadas que se puso de manifiesto que las estatinas interfieren con la cascada de coagulación (26). Asociado al uso de estatinas se ha observado la reducción inmediata (en menos de 72 horas tras su administración) de la formación de trombina (27).
 |
Tabla 3:
Efecto de la atorvastatina en los parámetros de coagulación en TEV |
Se ha observado, por ejemplo, que el tratamiento con simvastatina deprime la coagulación sanguínea, con disminución de activación de protrombina, generación de factor Va, escisión del fibrinógeno, activación del factor XIII y una mayor tasa de inactivación del factor Va. Estos efectos no se relacionaban con la reducción del colesterol (28).
Mas recientemente (2012) un estudio encontró evidencia de alteraciones rápidas (tres días) en la estructura y función del coágulo de fibrina, inducidas por las estatinas, en pacientes con trombosis venosa tratados con atorvastatina (Tabla 3) (29).
En el Multi-Ethnic Study of Atherosclerosis (MESA), un ensayo observacional de cohorte, con 6814 participantes sanos de ambos sexos (rango de edad entre 44 y 84 años), de los que 1001 estaban en tratamiento con estatinas al inicio del estudio, se realizaron análisis transversales (excluyendo a los que tomaban anticoagulantes). Se compararon los niveles medios de factores hemostáticos ajustados por edad, raza y sexo entre usuarios y no usuarios de estatinas, y se utilizaron modelos de regresión lineal multivariable para evaluar las asociaciones del uso de estatinas con factores hemostáticos, ajustados por edad, raza/etnia, educación, ingresos, uso de aspirina, terapia de reemplazo hormonal (en mujeres) y los principales factores de riesgo cardiovascular (30).
Los principales hallazgos de este estudio transversal fueron que el uso de estatinas se asoció con menor dímero D y factor VIII, mayor fibrinógeno y PAI-1. Se confirma, además, la reducción dosis-dependiente ya descrita de la PCR-hs, con el uso de estatinas. En cualquier caso, según los autores, las diferencias en la PCR explicaban en parte las asociaciones del uso de estatinas con el factor VIII, vWF y dímero D, pero no otros factores. Los niveles de lípidos no se relacionaron con diferencias en las asociaciones de factores hemostáticos al tratamiento con estatinas. Tampoco las diferencias en el grosor de la íntima-media carotídea explicaron las asociaciones observadas, sugiriendo que las asociaciones no se deben a una regresión de la aterosclerosis subclínica, como causa de menor activación hemostática. La mayor potencia de las estatinas se asoció solo con una PCR-hs más baja.
Por otra parte, tampoco hubo un impacto del nivel de LDL en las asociaciones del uso de estatinas con biomarcadores en este estudio. Además, aparte de con los niveles la PCR-hs, la potencia de las estatinas no se asoció con los niveles de biomarcadores (30).
Estatinas y prevención de TEV
La TEV es una enfermedad que puede tener consecuencias severas y cuyo tratamiento preventivo se basa en la terapia anticoagulante. Sin embargo, este tratamiento puede tener efectos secundarios graves de carácter hemorrágico. Desde hace tiempo existen datos que indican que las estatinas pueden constituir una alternativa adecuada para prevenir la TEV, ya que no inducen hemorragias, pero pueden reducir el riesgo de trombosis venosa. Ahora sabemos que las estatinas tienen varios efectos protectores vasculares, incluidas propiedades antiinflamatorias y antitrombóticas, que no están relacionados con cambios en el perfil de lípidos. Sin embargo, no está claro si la TEV se puede prevenir con el uso de estatinas, ya que los datos disponibles son escasos, controvertidos y probablemente sesgados, con pocos estudios replicados (25).
En los últimos años, varios ensayos han incidido sobre estos aspectos. El papel de las estatinas en la hemostasia y la profilaxis de la TEV aun no está completamente aclarado. Pero muchos datos indican que la terapia con estatinas podría constituir un tratamiento profiláctico alternativo para TEV, si se demuestra que estos fármacos regulan a la baja la hemostasia y previenen la TEV recurrente, sin aumentar el riesgo de hemorragia.
En 2019 un estudio (31) ha evaluado si el uso de rosuvastatina puede afectar a la generación de trombina en pacientes con TEV. El potencial y el pico de trombina endógena se redujeron, respectivamente, en un 10 y un 5%, asociados al tratamiento con rosuvastatina. El ensayo STAtins Reduce Thrombophilia (START) investigó si las estatinas afectan la coagulación en pacientes con TEV previa: Tras la retirada de la anticoagulación, durante 4 semanas o sin intervención. Las muestras de plasma tomadas al inicio y al final del estudio se analizaron empleando un ensayo de generación de trombina.
El estudio incluyó a 126 usuarios de rosuvastatina y 119 no usuarios. La edad media fue de 58 años, el 61% eran hombres, el 49% presentaba TEV no provocada y el 75% presentaba factores de riesgo cardiovascular (FRCV). El potencial de trombina endógena (ETP) aumentó desde el inicio hasta el final del estudio en no usuarios de estatinas (media 97,22 nm * min; IC del 95%, 40,92-153,53) y disminuyó en los usuarios de rosuvastatina (media -24,94 nm * min; IC del 95%, -71,81 a 21,93). La diferencia media en el cambio de ETP entre tratamientos fue de -120,24 nm * min (IC del 95%, -192,97 a -47,51), lo que produjo una reducción de ETP del 10,4% por rosuvastatina. El pico de trombina aumentó tanto en los usuarios que no tomaban estatinas (media 20,69 nm; IC del 95%, 9,80 a 31,58) como en los usuarios de rosuvastatina (media de 8,41 nm; IC del 95%: -0,86 a 17,69). La diferencia media en el cambio máximo entre tratamientos fue de -11,88 nm (IC del 95%, -26,11 a 2,35), lo que produjo una reducción máxima del 5% con rosuvastatina. Otros parámetros de generación de trombina no cambiaron sustancialmente. La reducción de la ETP y el pico de rosuvastatina fue más pronunciada en los subgrupos de participantes con FRCV y con TEV no provocada.
Los autores de este ensayo concluyen que la rosuvastatina reduce el potencial de generación de trombina en pacientes que tenían TEV (31).
Mucho mas recientemente (2021) (32) se ha vuelto a examinar la asociación entre rosuvastatina y riesgo de TEV y si los efectos varían en diferentes subpoblaciones estratificadas por factores demográficos clave, de ECV y otros factores de riesgo asociados con la TEV.
Para ello se realizó un metanálisis de datos de participantes individuales en dos ensayos controlados aleatorios en 30.507 participantes durante un seguimiento medio de 3,62 años; los individuos no tenían antecedentes de enfermedad vascular pero tenían un riesgo CV intermedio. En ambos ensayos, los participantes se asignaron al azar para recibir rosuvastatina o un placebo equivalente. El resultado primario fue aparición de TEV durante el seguimiento, definido como trombosis venosa profunda o embolia pulmonar. Se examinaron las asociaciones entre rosuvastatina y TEV en la cohorte agrupada general y las subpoblaciones se estratificaron por factores de riesgo demográfico (es decir, edad y sexo), factores de riesgo de ECV (es decir, obesidad, tabaquismo, niveles de lípidos, niveles de presión arterial y nivel de PCR-hs) y antecedentes de cáncer. La edad media fue de 65,96 (DE 7,19) años, y 17.832 (58,45%) eran hombres y 5.434 (17,82%) eran fumadores.2 , y la mediana del nivel de PCR fue de 3,4 (IQR 2,1–6,0) mg/L. Hubo 139 eventos de TEV. En la cohorte agrupada, la rosuvastatina se asoció con una gran reducción proporcional del riesgo de TEV (cociente de riesgo 0,53; IC del 95%: 0,37–0,75). No se observaron interacciones significativas entre el tratamiento con rosuvastatina y el riesgo de TEV en las subpoblaciones estratificadas por factores demográficos, de riesgo de ECV o antecedentes de cáncer (valores de P para interacciones > 0,05 para todos los subgrupos).
Por tanto, según este ensayo, la rosuvastatina se asocia, con una reducción proporcional del 47% en el riesgo de TEV, y su efecto es consistente tanto en presencia como en ausencia de factores de riesgo clínicos relacionados con TEV (32).
CONCLUSIONES:
Los datos de la literatura médica de las últimas dos décadas indican claramente que el tratamiento con estatinas puede tener un papel importante en la prevención de la enfermedad tromboembólica venosa. Sin embargo, quedan algunos aspectos por dilucidar, que se relacionan con los mecanismos fisiopatológicos que intervienen en el efecto antitrombótico de las estatinas, así como su relación con las diferentes etapas de la aterosclerosis. Todo parece indicar que el aumento de la actividad de la coagulación es mas específico de etapas tempranas de la aterosclerosis, aunque no se sabe si la aterosclerosis precoz aumenta el riesgo de la trombosis venosa (25).
Aunque es poco probable que las estatinas sean tan efectivas como los fármacos anticoagulantes, tienen la principal ventaja sobre los anticoagulantes de que no inducen hemorragias. Por tanto, un fármaco para prevenir la trombosis venosa recurrente en pacientes con riesgo de sangrado que no induzca sangrado y en el que el NNT, para la prevención de recidivas sea suficientemente elevado, es un remedio que debemos seguir buscando, y para el que, la terapia con estatinas. podría ser un candidato adecuado (25).
REFERENCIAS:
- Richard Kones. Rosuvastatin, inflammation, C-reactive protein, JUPITER, and primary prevention of cardiovascular disease--a perspective. Drug Des Devel Ther, 2010; 4:383-413.
- Ridker PM, Danielson E, Fonseca FAH, et al., (JUPITER Study Group). Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med, 2008; 359(21):2195-207.
- Mora S, Glynn RJ, Hsia J, MacFadyen JG, Genest J, Ridker PM. Statins for the primary prevention of cardiovascular events in women with elevated high-sensitivity C-reactive protein or dyslipidemia: results from the Justification for the Use of Statins in Prevention: An Intervention Trial Evaluating Rosuvastatin (JUPITER) and meta-analysis of women from primary prevention trials. Circulation, 2010; 121(9):1069-77.
- Fellström BC, Jardine AG, Schmieder RE, et al. (AURORA Study Group). Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009; 360(14):1395-407.
- Wanner C, Krane V, März W, Olschewski M, Mann JF, Ruf G, Ritz E, German Diabetes and Dialysis Study Investigators. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med. 2005; 353(3):238-48.
- Narla V, Blaha MJ, Blumenthal RS, Michos ED. The JUPITER and AURORA clinical trials for rosuvastatin in special primary prevention populations: perspectives, outcomes, and consequences.Vasc Health Risk Manag. 2009; 5:1033-1042.
- Grady D, Wenger NK, Herrington D, et al.. Postmenopausal hormone therapy increases risk for venous thromboembolic disease. The Heart and Estrogen/progestin Replacement Study. Ann Intern Med. 2000; 132:689–696.
- Law MR, Wald NJ, Rudnicka AR. Quantifying effect of statins on low density lipoprotein cholesterol, ischaemic heart disease, and stroke: systematic review and meta-analysis. BMJ. 2003; 326:1423
- Nissen SE, Nicholls SJ, Sipahi I, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA. 2006;295:1556–1565.
- Ray JG. Why might statins prevent venous thromboembolism: what needs to be done to know more? Expert Opin Investig Drugs. 2002 Nov;11(11):1659-68.
- Ray JG. Dyslipidemia, statins, and venous thromboembolism: a potential risk factor and a potential treatment. Curr Opin Pulm Med. 2003 Sep;9(5):378-84.
- Yang C-C, Jick SS, Jick H. Statins and the risk of idiopathic venous thromboembolism. BJ Clin Pharm, 2002; 53(1):101-105
- Pai M, Evans NS, Shah SJ, Greene D, Cook D, Crowther MA. Statins in the prevention of venous thromboembolism: A meta-analysis of observational studies. Thrombosis Research, 2011; 128(5):422-430.
- Horvei LD, GrimnesG, Hindberg K, et al. C-reactive protein, obesity, and risk of arterial and venous thrombosis. J Thromb Haemost. 2016;14:1561–1571.
- Hippisley-Cox J, Coupland C. Unintended effects of statins in men and women in England and Wales: population based cohort study using the QResearch database. BMJ. 2010; 340:c2197.
- Rahimi K, Bhala N, Kamphuisen P, et al. Effect of statins on venous thromboembolic events: a meta-analysis of published and unpublished evidence from randomised controlled trials. PLoS Med.2012; 9:e1001310.
- Glynn RJ, Danielson E, Fonseca FA, et al. A randomized trial of rosuvastatin in the prevention of venous thromboembolism. N Engl J Med. 2009; 360:1851–1861.
- Borissoff JI, Spronk HM, Ten Cate H. The hemostatic system as a modulator of atherosclerosis. N Engl J Med. 2011; 364:1746–1760.
- Borissoff JI, Otten JJ, Heeneman S, et al. Genetic and pharmacological modifications of thrombin formation in apolipoprotein e-deficient mice determine atherosclerosis severity and atherothrombosis onset in a neutrophil-dependent manner. PLoS One. 2013; 8(2):e55784.
- Kalz J, Ten Cate H, Spronk HM. Thrombin generation and atherosclerosis. J Thromb Thrombolysis. 2014; 37:45–55.
- Quist-Paulsen P, Naess IA, Cannegieter SC, et al. Arterial cardiovascular risk factors and venous thrombosis: results from a population-based, prospective study (the HUNT 2). Haematologica. 2010;95(1):119-125.
- Ridker PM, Rifai N, Pfeffer MA, et al. Long-term effects of pravastatin on plasma concentration of C-reactive protein. The Cholesterol and Recurrent Events (CARE) investigators. Circulation. 1999; 100:230–235.
- Żółciński M, Cieśla-Dul M, Potaczek DP, Undas A. Atorvastatin favorably modulates proinflammatory cytokine profile in patients following deep vein thrombosis. Thromb Res. 2013; 132(1):e31-5.
- Puccetti L, Santilli F, Pasqui AL, et al. Effects of atorvastatin and rosuvastatin on thromboxane-dependent platelet activation and oxidative stress in hypercholesterolemia. Atherosclerosis. 2011;214:122–128.
- Lijfering WM, Biedermann JS, Kruip MJ, Leebeek FW, Rosendaal FR, Cannegieter SC. Can we prevent venous thrombosis with statins: an epidemiologic review into mechanism and clinical utility. Expert Rev Hematol. 2016 Nov;9(11):1023-1030.
- Colli S, Eligini S, Lalli M, et al. Vastatins inhibit tissue factor in cultured human macrophages. A novel mechanism of protection against atherothrombosis. Arterioscler Thromb Vasc Biol. 1997;17:265–272.
- Undas A, Celinska-Löwenhoff M, Brummel-Ziedins KE, et al. Simvastatin given for 3 days can inhibit thrombin generation and activation of factor V and enhance factor Va inactivation in hypercholesterolemic patients. Arterioscler Thromb Vasc Biol. 2005;25:1524–1525.
- Undas A, Brummel KE, Musial J, et al. Simvastatin depresses blood clotting by inhibiting activation of prothrombin, factor V, and factor XIII and by enhancing factor Va inactivation. Circulation. 2001;103:2248–2253.
- Zolcinski M, Ciesla-DulM, Undas A. Effects of atorvastatin on plasma fibrin clot properties in apparently healthy individuals and patients with previous venous thromboembolism. Thromb Haemost. 2012;107:1180–1182.
- Adams NB, Lutsey PL, Folsom AR, et al. Statin therapy and levels of hemostatic factors in a healthy population: the multi-ethnic study of atherosclerosis. J Thromb Haemost. 2013;11:1078–1084.
- Orsi FA, Biedermann JS, Kruip MJHA, et al.. Rosuvastatin use reduces thrombin generation potential in patients with venous thromboembolism: a randomized controlled trial. J Thromb Haemost, 2019 Feb;17(2):319-328.
- Joseph P, Glynn R, Lonn E, Ramasundarahettige C, Eikelboom J, MacFadyen J, Ridker P, Yusuf S. Rosuvastatin for the prevention of venous thromboembolism: a pooled analysis of the HOPE-3 and JUPITER randomized controlled trials. Cardiovasc Res. 2021 Mar 10:cvab078. doi: 10.1093/cvr/cvab078. Epub ahead of print. PMID: 33705531.


No hay comentarios:
Publicar un comentario