 |
| Figura 1. Fenómenos biológicos con ritmicidad: Floración, migración e hibernación |
Parte I: ¿Quien me da la hora?
Los ritmos biológicos
La Cronobiología, es una disciplina que estudia los fenómenos biológicos desde el punto de vista temporal. Se ocupa del estudio de los ritmos biológicos, de su origen y de sus consecuencias en la actividad de los seres vivos.
Se define como Ritmo biológico a toda oscilación, regular en el tiempo, de una variable biológica, cualquiera que sea el nivel de organización que consideremos. Ello atañe a una gran variedad de fenómenos, como actividades y conductas de los seres vivos (desde las de los seres unicelulares a las de los mamíferos superiores, incluidos los humanos). Así que, fenómenos como la floración, las migraciones de las aves, la hibernación, etcétera, siguen una ritmicidad (Figura 1). Pero estos, a su vez, responden a procesos fisiológicos, mucho mas sutiles y menos evidentes, también rítmicos, repetitivos y con una periodicidad concreta, que tienen lugar a nivel humoral y molecular. En el siglo XIX, se consideraba que los ritmos biológicos eran respuestas pasivas de los organismos vivos a estímulos ambientales. Era la teoría predominante entre los científicos, encabezados por Claude Bernard. Sin embargo, a la luz de los conocimientos actuales, se sabe que, si bien muchos de estos ritmos responden a los cambios ambientales y forman parte de los mecanismos de adaptación de los seres vivos a su entorno, los ritmos biológicos son endógenos, predeterminados genéticamente.
 |
| Figura 2. Relación temporal entre los periodos sueño/vigilia con la temperatura corporal y los niveles de hormona del crecimiento, cortisol y K. |
En el organismo humano muchos procesos fisiológicos específicos, como la secreción hormonal, la temperatura corporal y el estado de alerta, entre otros, siguen ritmos concretos (Figura 2).
Los parámetros característicos de un ritmo biológico son:
- Periodo: intervalo entre dos episodios idénticos.
- Frecuencia: número de ciclos por unidad de tiempo
- Nivel medio (MESOR: Midline Estimating Statistic Of Rhythm ): Valor medio de la variable.
- Amplitud: diferencia entre mesor y valor máximo.
- Fase: relación entre dos o más ritmos
 |
| Figura 3. Gráfico de la secreción plasmática de cortisol en muestras seriadas a lo largo del día. |
Los ritmos biológicos pueden ser de frecuencia alta, media o baja, lo que se relaciona con la duración del periodo. El ritmo más conocido, por ser el más importante, es el ritmo circadiano (con una duración aproximada de 24 horas). El origen es el ritmo de la rotación terrestre, que genera la secuencia día/noche y, por tanto, la secuencia luz/oscuridad, así como los periodos de actividad/descanso (vigilia/sueño). Existen muchos otros ritmos, de periodos mas pequeños o mas grandes, que marcan los procesos biológicos. En la Tabla I se muestran los tipos de ritmos más frecuentes y los fenómenos biológicos relacionados con ellos.
2. Sincronización de ritmos
Una de las propiedades mas importantes de los ritmos biológicos es su plasticidad. Ello significa que, en presencia de un sincronizador externo ("zeitgeber" o "dador de tiempos", según el término introducido por Aschoff, que, si utilizáramos un término de origen latino, quizás deberíamos sustituir por el de hortator*), un ritmo biológico puede cambiar y adaptarse. El periodo de un ritmo endógeno, en ausencia de un sincronizador, se representa por la letra griega tau (τ), que se transforma en T (periodo del oscilador) por acción del zeitgeber.
El ciclo luz-oscuridad es el sincronizador más poderoso, tanto en animales como en plantas. En este sentido, los zeigebers ambientales o secundarios (por ejemplo la temperatura, la disponibilidad de alimentos o los factores sociales) pueden actuar manteniendo la sincronización de ritmos circadianos con periodos τ que difieran de las 24 horas, y afectar significativamente a los ritmos circadianos en muchas circunstancias.
El periodo τ, de un ritmo endógeno, es relativamente estable, en un mismo individuo, en la medida en que se mantengan estables las condiciones del zeitgeber. Sin embargo hay que tener en cuenta el llamado "post-efecto" del zeitgeber, que se refiere a modificaciones de τ, que dependen de una exposición continuada al sincronizador.
La intensidad del zeitgeber es un factor importante que Aschoff enunció, en relación con la luz, en sus "Leyes":
Los zeigebers ambientales actúan mediante el acoplamiento o relación de fase (φ), que representa la diferencia entre las acrofases del ritmo endógeno y su sincronizador ambiental. La acción del zeitgeber puede provocar el avance o el retraso de la fase del ritmo endógeno: avance de fase (φ positivo) o retraso de fase (φ negativo) (Figura 4).
La sincronización de un ritmo por el zeitgeber consiste en la modificación del periodo del ritmo (τ). Ello implica una corrección equivalente a la diferencia o relación de fase entre los dos periodos (φ). En relación con la luz, como sincronizador sobre un ritmo endógeno, hay que señalar que existen periodos de sensibilidad y de refractariedad, por lo que los efectos dependerán del momento del ciclo circadiano en que se aplique.
3. Sistema circadiano: Reloj central y relojes periféricos
El sistema circadiano se encuentra formado por las siguientes estructuras (Figura 5):
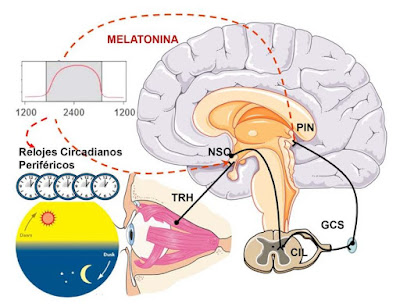
1) Un reloj biológico que en los mamíferos se sitúa en el núcleo supraquiasmático del hipotálamo (NSQ).
2) Las vías de sincronización, encargadas de proporcionar al reloj la información de las señales externas. Principalmente el tracto retino-hipotalámico (TRH) transmite la información luminosa de la retina hacia el NSQ para mantener una congruencia entre el reloj y el medio ambiente.
3) Las vías eferentes que transmiten las señales a los sistemas efectores que expresan los diferentes ritmos fisiológicos y conductuales órganos y sistemas orgánicos periféricos.
Ejemplos de sistemas efectores son: el eje hipotálamo-hipofisario-suprarrenal, el sistema cardiovascular, páncreas, hígado, intestino, sistema inmunitario y hematopoyético, el ciclo celular, la glándula pineal, etc. Todos estos sistemas se sincronizan con el NSQ a través de señales neuronales o sustancias que interaccionan con ellos, que pueden ser hormonas y neurotransmisores.
La secuencia de transiciones entre los tres estados fisiológicos principales de nuestra vida, la vigilia, el sueño lento o no-REM (NREM) y el sueño de movimientos oculares rápidos (REM), está organizado siguiendo un estricto orden temporal bajo el control del marcapasos central hipotalámico: el NSQ. En organismos complejos, como los mamíferos o las aves, se ha observado la expresión de una proteína (fos), que sigue un ritmo circadiano, en áreas del NSQ, con una curva de respuesta de fase coincidente con la curva de respuesta de fase a la luz. La expresión de esta proteína se relaciona con el oncogén de expresión temprana c-fos, cuya actividad parece formar parte de una cadena de eventos que traduce el efecto del zeitgeber luminoso. Otros genes de expresión temprana han sido estudiados en relación con la expresión de proteínas en el NSQ de mamíferos, como c-jun, jun-B, jun-D, NGFI-A y NGFI-B.
El reloj maestro en el NSQ se compone de numerosas células que actúan como osciladores individuales. El NSQ recibe información de la luz por el tracto TRH que coordina el reloj las 24 horas del día. El NSQ, a su vez, coordina a osciladores esclavos (periféricos) en otras áreas del cerebro (por ejemplo, la corteza) y en los órganos periféricos (por ejemplo, riñón, hígado, intestino).
 |
| Tabla I. Frecuencias de los ritmos biológicos |
Una de las propiedades mas importantes de los ritmos biológicos es su plasticidad. Ello significa que, en presencia de un sincronizador externo ("zeitgeber" o "dador de tiempos", según el término introducido por Aschoff, que, si utilizáramos un término de origen latino, quizás deberíamos sustituir por el de hortator*), un ritmo biológico puede cambiar y adaptarse. El periodo de un ritmo endógeno, en ausencia de un sincronizador, se representa por la letra griega tau (τ), que se transforma en T (periodo del oscilador) por acción del zeitgeber.
* Hortator es el término latino que define al tripulante de las galeras que vigilaba, animaba a los remeros y les marcaba la señal de remar. Equivalente al cómitre o nostromo en las galeras de la Edad Media y aproximadamente al contramaestre en los barcos modernos.Cuando hablamos de ritmo circadiano, circamareal, circanual, etc., asumimos que estamos hablando de ritmos endógenos. Las variaciones de τ revelan la variabilidad genética interespecies y entre individuos de una misma especie, aunque permanece constante para los diferentes ritmos de un mismo individuo.
El ciclo luz-oscuridad es el sincronizador más poderoso, tanto en animales como en plantas. En este sentido, los zeigebers ambientales o secundarios (por ejemplo la temperatura, la disponibilidad de alimentos o los factores sociales) pueden actuar manteniendo la sincronización de ritmos circadianos con periodos τ que difieran de las 24 horas, y afectar significativamente a los ritmos circadianos en muchas circunstancias.
El periodo τ, de un ritmo endógeno, es relativamente estable, en un mismo individuo, en la medida en que se mantengan estables las condiciones del zeitgeber. Sin embargo hay que tener en cuenta el llamado "post-efecto" del zeitgeber, que se refiere a modificaciones de τ, que dependen de una exposición continuada al sincronizador.
La intensidad del zeitgeber es un factor importante que Aschoff enunció, en relación con la luz, en sus "Leyes":
- 1ª Ley: El aumento de la intensidad luminosa prolonga el tiempo de actividad y acorta el tiempo de reposo en especies diurnas, mientras que disminuye el tiempo de actividad y aumenta el tiempo de reposo en las nocturnas.
- 2ª Ley: Al aumentar la intensidad luminosa aumenta la actividad de las especies diurnas y disminuye la de las nocturnas.
- 3ª Ley: τ es mayor de 24 horas en las especies diurnas y menor de 24 horas en las nocturnas.
Los zeigebers ambientales actúan mediante el acoplamiento o relación de fase (φ), que representa la diferencia entre las acrofases del ritmo endógeno y su sincronizador ambiental. La acción del zeitgeber puede provocar el avance o el retraso de la fase del ritmo endógeno: avance de fase (φ positivo) o retraso de fase (φ negativo) (Figura 4).
 |
| Figura 4. Acoplamiento de fase tras activación del zeitgeber |
La sincronización de un ritmo por el zeitgeber consiste en la modificación del periodo del ritmo (τ). Ello implica una corrección equivalente a la diferencia o relación de fase entre los dos periodos (φ). En relación con la luz, como sincronizador sobre un ritmo endógeno, hay que señalar que existen periodos de sensibilidad y de refractariedad, por lo que los efectos dependerán del momento del ciclo circadiano en que se aplique.
3. Sistema circadiano: Reloj central y relojes periféricos
El sistema circadiano se encuentra formado por las siguientes estructuras (Figura 5):
1) Un reloj biológico que en los mamíferos se sitúa en el núcleo supraquiasmático del hipotálamo (NSQ).
2) Las vías de sincronización, encargadas de proporcionar al reloj la información de las señales externas. Principalmente el tracto retino-hipotalámico (TRH) transmite la información luminosa de la retina hacia el NSQ para mantener una congruencia entre el reloj y el medio ambiente.
3) Las vías eferentes que transmiten las señales a los sistemas efectores que expresan los diferentes ritmos fisiológicos y conductuales órganos y sistemas orgánicos periféricos.
 |
| Figura 5. Representación esquemática del NSQ, unido a la retina por el TRH, y de los osciladores esclavos en el cortex cerebral y en órganos perifericos |
 |
| Figura 6. Organización jerárquica del mecanismo circadiano. Relación entre el NSQ y los relojes circadianos periféricos |
 |
| Figura 7. Diagrama esquemático del sistema NSQ y de vías aferentes y eferentes |
En situación de estabilidad ambiental, es decir, sin condicionantes externos (por ejemplo alimentarios, meteorológicos o sociales), los ritmos circadianos tienen un periodo aproximadamente de 24 h.. El control de reloj ejercido por el NSQ, es "reseteado" diariamente por la alternancia luz-oscuridad a través del TRH. Sin embargo, otras señalizaciones rítmicas, como los periodos de alimentación y los relacionados con la motilidad o el ejercicio físico, pueden moderar o alterar el ritmo circadiano.
4. Bases moleculares de los ritmos biológicos
Determinación genética
Se sabe que los ritmos biológicos están determinados genéticamente. Investigaciones realizadas inicialmente en organismos unicelulares, como algas y metazoos, pusieron de manifiesto los efectos de la inhibición de síntesis de determinadas proteínas y de ARN sobre el sistema circadiano. En las algas unicelulares se ha observado que, en elementos enucleados, persiste el ritmo de fotosíntesis durante semanas. Por otra parte el trasplante de núcleo de un ejemplar a otro enucleado, hace que el receptor adopte el ritmo del donante. La aplicación de inhibidores de la ARN-polimerasa (como la actinomicina D) suprime el ritmo circadiano en el elemento celular intacto, pero no en el enucleado. Ello hace pensar que el ARN sintetizado, que codifica el ritmo de fotosíntesis, persiste durante mucho tiempo en el citoplasma, mientras que la continuidad de la transcripción con síntesis de ARNm no parece ser estrictamente necesaria para el funcionamiento de un oscilador interno. Diversas experiencias han demostrado que las proteínas implicadas en la expresión de los ritmos circadianos son citoplasmáticas.
Los estudios de individuos con ritmos mutantes, tanto en hongos (Neurospora crasa), invertebrados (Drosophila melanogaster), como en vertebrados (Hamsters), ha permitido detectar genes relacionados con la ritmicidad, que mantienen una gran homología entre especies de diferentes reinos vivos. En Drosophila melanogaster se aislaron cepas mutantes con periodos alterados de los ritmos circadianos (eclosión y actividad motora). Las consecuencias de la mutación fueron, en unos casos, cambios arrítmicos y en otros con τ menores o mayores de 24 horas. A estos genes mutantes se les denominó perS (short period) y perL (long period). Mediante técnicas de biología molecular fue posible clonar y secuenciar el gen per, que consiste en un fragmento de ADN de 7,7 Kb. La proteína resultante de la transcripción del gen per se ha identificado como un proteoglicano (proteínas altamente glicosiladas) de 1227 aminoácidos. Técnicas de inmunofluorescencia han puesto de manifiesto la amplia distribución de la proteína per en órganos y tejidos de la Drosophila y su vinculación a las uniones intercelulares. También se ha identificado un grupo de 15 neuronas cerebrales, situadas a cada lado del cerebro de la Drosophila, con una expresión de per muy elevada, por lo que se supone que constituyen el mecanismo oscilador primario. La proteína per tiene un mecanismo de retroalimentación sobre su propia síntesis.
Por tanto, el ritmo circadiano está presente, de forma universal. Desde la vida unicelular a organismos complejos y juega un papel importante en procesos fisiológicos como el ciclo sueño-vigilia en mamíferos. En los mamíferos, un gran número de genes experimentan una oscilación circadiana en sus niveles de expresión. Por integración de todos los experimentos de microensayos disponibles en ritmo circadiano en diferentes tejidos y especies en mamíferos, se han identificado un conjunto de genes circadianos comunes que se encuentran en el centro del reloj circadiano. En las diferencias significativas en la expresión génica de la oscilación circadiana entre ratón, rata, macaco y humano subyacen sus diferencias fisiológicas y de comportamiento.
El análisis de la red de genes reguladores circadianos en ratones, ha puesto de manifiesto, no sólo lazos de retroalimentación adicionales en red, que contribuyen a la robustez de los relojes circadianos, sino también cómo los factores ambientales como la luz, la comida y el calor pueden modificar el ritmo circadiano como zeitgeber.
4. Bases moleculares de los ritmos biológicos
Determinación genética
Se sabe que los ritmos biológicos están determinados genéticamente. Investigaciones realizadas inicialmente en organismos unicelulares, como algas y metazoos, pusieron de manifiesto los efectos de la inhibición de síntesis de determinadas proteínas y de ARN sobre el sistema circadiano. En las algas unicelulares se ha observado que, en elementos enucleados, persiste el ritmo de fotosíntesis durante semanas. Por otra parte el trasplante de núcleo de un ejemplar a otro enucleado, hace que el receptor adopte el ritmo del donante. La aplicación de inhibidores de la ARN-polimerasa (como la actinomicina D) suprime el ritmo circadiano en el elemento celular intacto, pero no en el enucleado. Ello hace pensar que el ARN sintetizado, que codifica el ritmo de fotosíntesis, persiste durante mucho tiempo en el citoplasma, mientras que la continuidad de la transcripción con síntesis de ARNm no parece ser estrictamente necesaria para el funcionamiento de un oscilador interno. Diversas experiencias han demostrado que las proteínas implicadas en la expresión de los ritmos circadianos son citoplasmáticas.
Los estudios de individuos con ritmos mutantes, tanto en hongos (Neurospora crasa), invertebrados (Drosophila melanogaster), como en vertebrados (Hamsters), ha permitido detectar genes relacionados con la ritmicidad, que mantienen una gran homología entre especies de diferentes reinos vivos. En Drosophila melanogaster se aislaron cepas mutantes con periodos alterados de los ritmos circadianos (eclosión y actividad motora). Las consecuencias de la mutación fueron, en unos casos, cambios arrítmicos y en otros con τ menores o mayores de 24 horas. A estos genes mutantes se les denominó perS (short period) y perL (long period). Mediante técnicas de biología molecular fue posible clonar y secuenciar el gen per, que consiste en un fragmento de ADN de 7,7 Kb. La proteína resultante de la transcripción del gen per se ha identificado como un proteoglicano (proteínas altamente glicosiladas) de 1227 aminoácidos. Técnicas de inmunofluorescencia han puesto de manifiesto la amplia distribución de la proteína per en órganos y tejidos de la Drosophila y su vinculación a las uniones intercelulares. También se ha identificado un grupo de 15 neuronas cerebrales, situadas a cada lado del cerebro de la Drosophila, con una expresión de per muy elevada, por lo que se supone que constituyen el mecanismo oscilador primario. La proteína per tiene un mecanismo de retroalimentación sobre su propia síntesis.
Por tanto, el ritmo circadiano está presente, de forma universal. Desde la vida unicelular a organismos complejos y juega un papel importante en procesos fisiológicos como el ciclo sueño-vigilia en mamíferos. En los mamíferos, un gran número de genes experimentan una oscilación circadiana en sus niveles de expresión. Por integración de todos los experimentos de microensayos disponibles en ritmo circadiano en diferentes tejidos y especies en mamíferos, se han identificado un conjunto de genes circadianos comunes que se encuentran en el centro del reloj circadiano. En las diferencias significativas en la expresión génica de la oscilación circadiana entre ratón, rata, macaco y humano subyacen sus diferencias fisiológicas y de comportamiento.
El análisis de la red de genes reguladores circadianos en ratones, ha puesto de manifiesto, no sólo lazos de retroalimentación adicionales en red, que contribuyen a la robustez de los relojes circadianos, sino también cómo los factores ambientales como la luz, la comida y el calor pueden modificar el ritmo circadiano como zeitgeber.
 |
| Figura 8. Red de genes circadianos en el ratón y los puntos de interacción en dicha red de zeitgebers externos (luz, alimento y calor). Yun Yan et al. |
El reloj molecular en los mamíferos implica varios genes del reloj con patrones temporales específicos de expresión. La sincronización del reloj circadiano situado en el NSQ se lleva a cabo, principalmente, a través de la reposición diaria de la fase del reloj en respuesta a los estímulos luminosos. El desplazamiento de fase en respuesta a la luz se correlaciona con la inducción de Per1 (PerS) y Per2 (PerL) dentro de las células supraquiasmáticas.
El mecanismo íntimo del reloj comprende bucles interactivos positivos (CLOCK y BMAL1) y negativos (PER y CRY) de retroalimentación. Las proteínas CLOCK y BMAL1 forman heterodímeros y activan la transcripción del Per, Cry y genes Rev-Erbα a través de potenciadores E-box. A medida que los niveles de proteínas PER aumentan, forman complejos con las proteínas Cry y CKIεCKIδ, y son fosforiladas. En el núcleo, el complejo CRY–PER–CKIεCKIδ se asocia con los heterodímeros CLOCK-BMAL1 para detener la transcripción, mientras el heterodímero permanece unido al ADN, formando así el bucle de retroalimentación negativa. Para el circuito de retroalimentación positiva, el aumento de los niveles de Rev-Erbα actúa a través de los elementos de respuesta Rev-Erb/ROR en el promotor Bmal1 para reprimir la transcripción de Bmal1. La inhibición mediada por CRY de la transcripción mediada por CLOCK-BMAL1 de-reprime (es decir activa) la transcripción Bmal1, porque la represión mediada por Rev-Erbα se inhibe. Un activador podría regular positivamente la transcripción BMAL1, solo o mediante la interacción con mPER2. Probablemente hay otras quinasas, diferentes de CKIε y CKIδ, que participan en la fosforilación de proteínas despertador (Figura 9).
 |
| Figura 9. Representación de los mecanismos moleculares del reloj circadiano celular (Albrecht, U) |
El mecanismo del reloj consta de dos partes:
- Un bucle de retroalimentación transcripcional-traduccional (TTL), que consiste en un mecanismo positivo (verde en la figura 9) y otro negativo (rojo en la figura anterior).
- Un proceso post-oscilación. Modificación traslacional de productos genéticos en la TTL (círculo amarillo marcado con P en la figura anterior), que regula degradación y/o localización nuclear de estas proteínas (flechas naranjas en la figura 9).
Mecanismos efectores
Mediadores humorales
Determinadas vías de salida o eferentes son responsables de la coordinación del ritmo circadiano entre diferentes funciones y la mayoría de los tejidos periféricos y órganos. Estos mecanismos de coordinación se atribuyen a la intervención de mediadores humorales, entre los que se proponen la prokineticina-2 (PK2), el factor de crecimiento tumoral α (TGFα), o la cardiotrophin-like cytokine (CLCF1) y de vías neurales, a través de cambios rítmicos en el balance entre los impulsos simpáticos y parasimpáticos. Pero también interviene la liberación de melatonina por la glándula pineal durante la noche.
 |
| Tabla II. Resultado funcional neuroendocrino de las proyecciones del NSQ. |
Factor de crecimiento tumoral α (TGFα)
El factor de crecimiento tumoral alfa (TGF-alfa) es un probable inhibidor de actividad de locomoción del NSQ. TGF-alfa se expresa rítmicamente en el NSQ, y cuando se infunde en el tercer ventrículo inhibe reversiblemente la actividad locomotora y altera los ciclos circadianos del sueño y vigilia. Estas acciones están mediadas por los receptores del factor de crecimiento epidérmico (EGF) en las neuronas en la zona subparaventricular hipotalámica.
Los ratones con una mutación del receptor de EGF hipomórfico exhibieron actividad locomotora diurna excesiva y no suprimieron la actividad cuando se expusieron a la luz. Estos resultados implican la señalización del receptor de EGF en el control diario de la actividad locomotora e identifican un circuito neuronal en el hipotálamo que, probablemente, media la regulación del comportamiento tanto por el NSQ como por la retina.
Cardiotrophin-like cytokine (CLC)
La CLC satisface también múltiples criterios como regulador circadiano de la actividad locomotora. En el ratón, la CLC se expresa en una subpoblación de neuronas de vasopresina del NSQ, con un ritmo circadiano que alcanza su punto máximo durante el período diario de inactividad del aparato locomotor. Los receptores de CLC flanquean el tercer ventrículo, y la infusión aguda de CLC en el tercer ventrículo produce un bloqueo transitorio de la actividad locomotora sin afectar el reloj circadiano. La infusión hipotalámica de anticuerpos neutralizantes para el receptor de CLC produjo actividad locomotora diaria adicional en el momento en que la CLC se expresa al máximo. Estos resultados sugieren que CLC es probablemente una señal de salida SCN importante para dar forma a los ritmos diarios de comportamiento; además, indican un papel inesperado para una citoquina en la función cerebral del adulto.
Prokineticina-2
En mamíferos el gen PROK2 codifica la expresión de una proteína en el NSQ (la prokineticina-2), que podría funcionar como una de las vías de salida del reloj circadiano. La forma secretada de la proteína también actua como quimioatractor para células precursoras neuronales en el bulbo olfativo. Basándose en estudios de homologías, en otros vertebrados, se han aislado proteínas similares que tienen efectos diversos. Una mutación en el gen PROK2 está relacionado con el síndrome de Kallman 4, caracterizado por hipogonadismo y anosmia.
Sin embargo, los resultados de algunos estudios recientes sugieren que, en humanos, la señalización mediada por la proteína PK2 no parece necesaria para el funcionamiento normal del marcapasos central del NSQ. Aunque sí parece relacionarse con la ritmicidad de tipo psicomotora, basándose en el daño de tareas de vigilancia psicomotora, que se produce en sujetos con nula expresión de la proteína PK2. Ello indicaría que PK2 podría transmitir datos de sincronización a determinadas redes neuronales relacionales con comportamientos motores.
Melatonina
La melatonina, originariamente descubierta como hormona de la glándula pineal (Figura 10), es producida por bacterias, protozoos, plantas, hongos, invertebrados, y en los vertebrados, en varios tejidos además de la pineal. Esta sorprendente conservación filogenética sugiere que sus funciones son relevantes para el funcionamiento celular. Las acciones de la melatonina son múltiples y están mediadas por la interacción con receptores de membrana (receptores MT 1 y MT 2) y nucleares (receptores RZR/RORα y RZRβ), por interacción con proteínas intracelulares y por interacciones químicas, como las vinculadas con la actividad antioxidante del compuesto y sus metabolitos (Figura 11). Más recientemente, se ha prestado atención a los efectos mitocondriales de la melatonina, incluida la salvaguarda del flujo de electrones en la cadena de oxidación intermedia, la reducción de la formación de ROS (reactive oxygen species) mediante la reducción de la fuga de electrones, y la inhibición de la apertura del poro de transición de permeabilidad mitocondrial.
Pleiotropia de la melatonina
La melatonina muestra una multiplicidad excepcional de acciones (pleiotropía), como se describirá a continuación. Éstas son entendidas sobre la base del papel integrador que distingue a la melatonina de muchas otras moléculas importantes. La pleiotropía de la melatonina puede ser analizada desde diferentes niveles:
- Multiplicidad y distribución de receptores.
- Multiplicidad de sitios de síntesis y órganos efectores.
- Multiplicidad de efectos intracelulares –con un enfoque particular sobre sus acciones mitocondriales–.
 |
| Figura 11. Efectos celulares de la melatonina mediados y no mediados por receptores |
Implicaciones metabólicas de la melatonina
La hormona pineal melatonina ejerce su influencia en la periferia a través de la activación de dos receptores de membrana específicos: MT1 y MT2, que transmiten sus señales a través de la unión de proteínas al trifosfato de guanosina (GTP) (G-proteínas). La melatonina ejerce una acción inhibitoria sobre la secreción de insulina mediante la activación de la cascada de señalización de la proteína Gi que involucra monofosfato de adenosina cíclico (cAMP) (señalización dependiente de MT1) o cAMP y monofosfato de guanosina cíclica (cGMP) como segundos mensajeros (MT2). Ambas isoformas se expresan en los islotes de Langerhans y están implicadas en la modulación de la secreción de insulina por las células β y en la secreción de glucagón por las células α.
La melatonina regula a la baja la actividad de adenilato o guanilato ciclasa, lo que lleva a una reducción de los niveles de segundo mensajero y una actividad atenuada de la proteína quinasa A (pKA) o proteína quinasa G (pKG). Consecutivamente se reduce la secreción de insulina.
Como efecto secundario de la fosforilación y activación del factor de transcripción modulado por cAMP, la proteína de unión al elemento de respuesta a cAMP (CREB) se regula a la baja. Además, también se sabe que el receptor MT1 se acopla a proteínas Gq y, por lo tanto, modula los niveles de IP3 y Ca2 + internos de las células. La señalización de melatonina incide en el ritmo de un reloj circadiano autónomo, ubicado en un islote, como un sincronizador. Este ritmo se genera por la acción antifásica de los genes del reloj Per y Cry (que codifican un heterodímero con acción inhibitoria) o Bmal y Clock (que producen proteínas heterodiméricas con acción de mejora transcripcional).
La hormona pineal melatonina ejerce su influencia en la periferia a través de la activación de dos receptores de membrana específicos: MT1 y MT2, que transmiten sus señales a través de la unión de proteínas al trifosfato de guanosina (GTP) (G-proteínas). La melatonina ejerce una acción inhibitoria sobre la secreción de insulina mediante la activación de la cascada de señalización de la proteína Gi que involucra monofosfato de adenosina cíclico (cAMP) (señalización dependiente de MT1) o cAMP y monofosfato de guanosina cíclica (cGMP) como segundos mensajeros (MT2). Ambas isoformas se expresan en los islotes de Langerhans y están implicadas en la modulación de la secreción de insulina por las células β y en la secreción de glucagón por las células α.
La melatonina regula a la baja la actividad de adenilato o guanilato ciclasa, lo que lleva a una reducción de los niveles de segundo mensajero y una actividad atenuada de la proteína quinasa A (pKA) o proteína quinasa G (pKG). Consecutivamente se reduce la secreción de insulina.
Como efecto secundario de la fosforilación y activación del factor de transcripción modulado por cAMP, la proteína de unión al elemento de respuesta a cAMP (CREB) se regula a la baja. Además, también se sabe que el receptor MT1 se acopla a proteínas Gq y, por lo tanto, modula los niveles de IP3 y Ca2 + internos de las células. La señalización de melatonina incide en el ritmo de un reloj circadiano autónomo, ubicado en un islote, como un sincronizador. Este ritmo se genera por la acción antifásica de los genes del reloj Per y Cry (que codifican un heterodímero con acción inhibitoria) o Bmal y Clock (que producen proteínas heterodiméricas con acción de mejora transcripcional).
 |
| Figura 12. Señalización de melatonina sobre la célula β |
 |
| Figura 13. Representación del antagonismo insulina-melatonina, en relación con la importancia de la melatonina en la DM1 y DM2. Incluyendo las interaciones con glucagón y catecolaminas. |
Por lo tanto, la influencia de la insulina en los pinealocitos está mediada por los receptores de insulina en la glándula pineal (figura 13), y la influencia de la melatonina en las células β pancreáticas está mediada por los receptores de melatonina MT1 y MT2.
Por otra parte, la relación insulina-catecolamina, puede ser una clave para comprender el antagonismo insulina-melatonina. El aumento de catecolaminas estimula el adrenoceptor β1 y, en consecuencia, la cascada de cAMP, mientras que el adrenoceptor α1 activa la cascada de IP3 en la glándula pineal, que estimula la síntesis y secreción de melatonina.
Las catecolaminas (al contrario que la acetilcolina), tienen un efecto inhibitorio sobre la secreción de insulina. En este sentido, el modelo de rata GK de DM2, muestra catecolaminas plasmáticas disminuidas, mientras que los modelos de rata de DM1 (STZ y LEW.1AR1-iddm) exhiben catecolaminas incrementadas. Ello respalda la convicción de que la DM1 está asociada con el estrés y una mayor secreción de melatonina. Una explicación del aumento de los niveles de melatonina en ratas STZ DM1 y posiblemente también en ratas LEW.1AR1-iddm podría ser que la melatonina protege el organismo al atenuar el daño de las células β inducido por el estrés oxidativo en la DM1.
Vías neurales
Los cambios rítmicos del balance simpático/parasimpático pueden representar una vía de control autonómico. Las señales parasimpáticas y simpáticas opuestas determinan la salida autonómica del cerebro al cuerpo y el cambio en el equilibrio durante el ciclo sueño-vigilia. El NSQ organiza el ciclo de actividad/inactividad y los comportamientos que lo acompañan, pero no está claro cómo el hipotálamo, y en particular el NSQ, con su alta actividad eléctrica diurna, influye en este equilibrio autonómico diferenciado. En una primera serie de experimentos, visualizamos las neuronas pre-simpáticas hipotalámicas inyectando el trazador retrógrado Fluoro-Gold en los núcleos simpáticos torácicos de la médula espinal.
Las neuronas pre-parasimpáticas se revelaron mediante la inyección del virus retrógrado trans-sináptico pseudorabies (PRV) en el hígado y por la denervación simpática del hígado, lo que obligó al virus a infectarse a través del nervio vago solamente. Este enfoque reveló neuronas pre-simpáticas y pre-parasimpáticas separadas en el tronco encefálico y el hipotálamo. A continuación, el rastreo retrógrado selectivo con dos cepas PRV reportero únicas, una inyectada en la suprarrenal y la otra en el hígado denervado simpático, demostró que hay dos poblaciones separadas de neuronas pre-simpáticas y pre-parasimpáticas dentro del núcleo paraventricular del hipotálamo. Curiosamente, esta segregación persiste en el NSQ, donde, como resultado, el equilibrio entre el día y la noche en la función autonómica de los órganos se ve afectado por neuronas NSQ especializadas pre-simpáticas o pre-parasimpáticas. Estas neuronas NSQ preautonómicas separadas proporcionan la base anatómica para la regulación dirigida circadiana de la producción autonómica parasimpática y simpática.
BIBLIOGRAFÍA:
- Daniel P. Cardinali y Pablo A. Scacchi Bernasconi. Ritmos Biológicos en Neuroendocrinología. Revista SAEGRE noviembre, 2009. Vol 16(3): 5-25.
- Cardinali, D. P. y Golombek, D.A.. Naturaleza y propiedades de los ritmos biológicos. En: "Introducción a la Cronobiología: fisiología de los ritmos biológicos". Editores: Daniel P. Cardinali, Juan J. Jordá Catalá y Emilio J. Sánchez Barceló. Servicio de Publicaciones de la Universidad de Cantabria. ISBN: 84-8102-52-4. Santander 1994.
- Aschoff J. Human circadian rhythms in activity, body temperature and other functions. Life Sci Space Res 1967; 5:159-73.
- Yan J, Wang H, Liu Y, Shao C (2008) Analysis of Gene Regulatory Networks in the Mammalian Circadian Rhythm. PLoS Comput Biol 4(10): e1000193
- Cardinali, D. P. y Golombek, D.A.. Mecanismos moleculares, celulares y fisiológicos de la ritmicidad circadiana. En: "Introducción a la Cronobiología: fisiología de los ritmos biológicos". Editores: Daniel P. Cardinali, Juan J. Jordá Catalá y Emilio J. Sánchez Barceló. Servicio de Publicaciones de la Universidad de Cantabria. ISBN: 84-8102-52-4. Santander 1994.
- Urs Albrecht. Timing to Perfection: The Biology of Central and Peripheral Circadian Clocks. Neuron. April 26, 2012; 74:246-260.
- Joseph S. Takahashi, Hee-Kyung Hong, Caroline H. Ko and Erin L. McDearmon. The genetics of mammalian circadian order and disorder: implications for physiology and disease NATURE REVIEWS | genetics. October 2008; 9: 764-775.
- Kramer A, et al. Regulation of daily locomotor activity and sleep by hypothalamic EGF receptor signaling. Science. 2001 Dec 21; 294(5551):2511-5.
- Kraves S, Weitz CJ. A role for cardiotrophin-like cytokine in the circadian control of mammalian locomotor activity. Nat Neurosci. 2006 Feb; 9(2):212-9.
- Elmar Peschke, Ina Bähr, and Eckhard Mühlbauer. Melatonin and Pancreatic Islets: Interrelationships between Melatonin, Insulin and Glucagon. Int J Mol Sci. 2013 Apr; 14(4): 6981–7015.
- Radomir M. Slominskia,b, Russel J. Reiterc, Natalia Schlabritz-Loutsevitchd, Rennolds S. Ostroma, and Andrzej T. Slominskib. Melatonin membrane receptors in peripheral tissues: Distribution and functions. Mol Cell Endocrinol. 2012 April 4; 351(2): 152–166
- L.A. Sadacca & K.A. Lamia & A.S. deLemos & B. Blum & C J. Weitz. Diabetologia (2011); 54:120–124
No hay comentarios:
Publicar un comentario